
ÁCIDO FUERTE + BASE FUERTE:
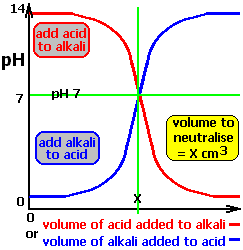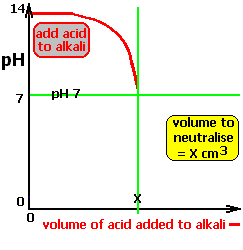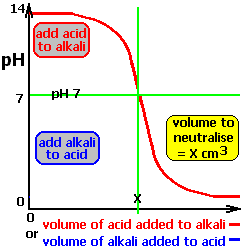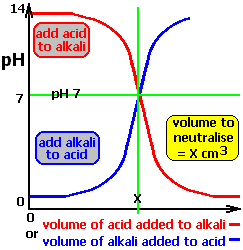
Cuando un ácido fuerte se neutraliza con una base fuerte, el pH experimenta una brusca variación justamente en el punto de equivalencia.
Tomemos por ejemplo una disolución 0,1N de HCl. La [H+] es 10-1 M, y el pH=1. Si se añade 0,1N NaOH, los OH- consumen los H+ para originar agua. Cuando se han neutralizado 9/10 partes del ácido, [H+]=10-2 M y pH=2. Si se han neutralizado 999/1000 partes del ácido, [H+]=10-4 M y el pH=4. Basta entonces añadir 2/1000 partes de NaOH para neutralizar todo el ácido y originar un exceso de iones OH-, que estarán a una concentración 10-4 M, y un pH=10 (Ver tabla inferior).
Equivalentes de NaOH añadidos (total)
|
Equivalentes ácido restantes
|
Equivalentes base presentes
|
pH
|
0
|
0,1
|
0
|
1
|
0,09
|
0,01
|
0
|
2
|
0,0999
|
0,0001
|
0
|
4
|
0,1000
|
0
|
0
|
7
|
0,1001
|
0
|
0,0001
|
10
|
Las 2/1000 partes de la base que han sido añadidas en las dos últimas adiciones han provocado un brusco cambio en el pH de 6 unidades, mientras que anteriormente, la neutralización del 90% de los equivalentes del ácido (lograda tras la primera adición) sólo consiguió elevar el pH en una unidad. El punto de la curva en queel número de equivalentes de base añadidos iguala al número de equivalentes de ácido es el punto de equivalencia o punto de neutralización, y en este momento pH=7 (Ver figuras inferiores). Este enlace te lleva a una animación del proceso.
Los ácidos polipróticos presentan tantos puntos de equivalencia como protones capaces de disociarse. En el caso del ácido fosfórico, que es triprótico, la valoración completa precisa la adición de 3 equivalentes OH-por cada mol de ácido. Hay tres equilibrios de disociación, cada uno con su pKa característico (Ver figuras inferiores).
Valoración del ácido fosfórico
|
Abundancia relativa de cada especie iónica
|
ÁCIDO FUERTE + BASE DÉBIL:
 Cuando un ácido fuerte como el HCl se neutraliza con una base débil (NH3), el pH se mantiene muy bajo mientras mientras aún existe ácido libre y después de alcanzar la neutralidad, el ligero exceso de NH3 eleva paulatinamente el pH, sin provocar cambios bruscos (Figura de la derecha). En este caso, en el punto de equivalencia (igual número de equivalentes de ácido y de base) el pH < 7.
Cuando un ácido fuerte como el HCl se neutraliza con una base débil (NH3), el pH se mantiene muy bajo mientras mientras aún existe ácido libre y después de alcanzar la neutralidad, el ligero exceso de NH3 eleva paulatinamente el pH, sin provocar cambios bruscos (Figura de la derecha). En este caso, en el punto de equivalencia (igual número de equivalentes de ácido y de base) el pH < 7.
En la gráfica se puede observar que el eje horizontal indica el volumen de base (en mL) que se le añade al ácido y que el eje vertical indica el PH que va tomando la disolución. En esta gráfica observamos cómo al principio el HCl tiene un PH muy bajo (es muy ácido) hasta que se le echan 25 mL de NH3 que se vuelve neutro. A partir de los 25 mL la disolución será siempre básica.
ÁCIDO DÉBIL + BASE FUERTE:
Si tenemos un ácido débil, por ejemplo 0,1N de ácido acético, el pH inicial es 2,88 y al añadir una base fuerte(0,1N NaOH) el pH se va aproximando a la neutralidad sin cambios bruscos, pero una vez neutralizado el ácido basta añadir unas gotas de sosa en exceso para obtener un incremento brusco en el pH como si sólo hubiera base libre (Figura de la derecha). En este caso, en el punto de equivalencia (cuando se ha añadido el mismo número de equivalentes de base que de ácido) el pH > 7 (Figura izquierda de la tabla inferior). En el punto en que se hanneutralizado la mitad de los equivalentes de ácido, [AH]=[A-] y el pH = pKa (Figura derecha de la tabla inferior).
Si tenemos un ácido débil, por ejemplo 0,1N de ácido acético, el pH inicial es 2,88 y al añadir una base fuerte(0,1N NaOH) el pH se va aproximando a la neutralidad sin cambios bruscos, pero una vez neutralizado el ácido basta añadir unas gotas de sosa en exceso para obtener un incremento brusco en el pH como si sólo hubiera base libre (Figura de la derecha). En este caso, en el punto de equivalencia (cuando se ha añadido el mismo número de equivalentes de base que de ácido) el pH > 7 (Figura izquierda de la tabla inferior). En el punto en que se hanneutralizado la mitad de los equivalentes de ácido, [AH]=[A-] y el pH = pKa (Figura derecha de la tabla inferior).
punto de equivalencia
|
pKa
|


No hay comentarios:
Publicar un comentario